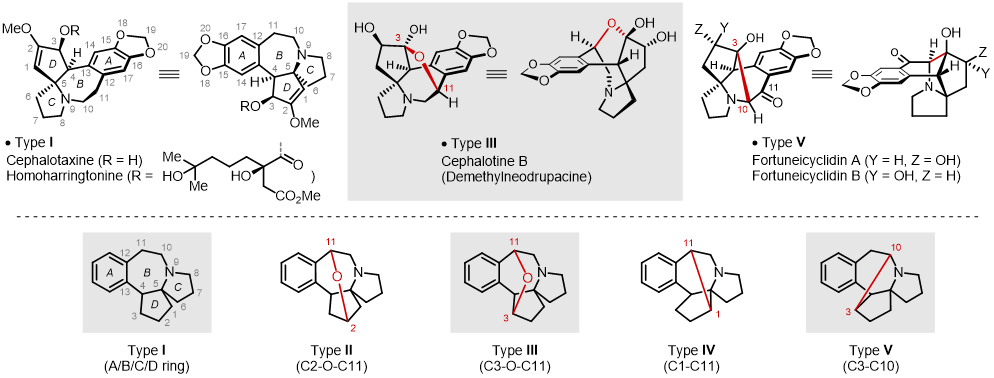
图一:部分三尖杉碱类型生物碱及其主要骨架类型 (图片来源:J. Am. Chem. Soc.)
天然三尖杉类生物碱 (Cephalotaxus Alkaloids) 来源于三尖杉属植物,该类植物分布于东亚南部及中南半岛,主产于中国,为常绿乔木或灌木。上个世纪50年代,化学家发现三尖杉属植物中含有生物碱化合物;1963年,Paudler等人从三尖杉的枝叶中首次分离得到了“三尖杉碱 (Cephalotaxine)”;2016年中国科学院昆明植物研究所蔡祥海课题组从贡山三尖杉(Cephalotaxus lanceolata)与高山三尖杉(Cephalotaxus fortunei var. alpina)中分离并鉴定了Cephalotine B,值得一提的是,该类化合物曾于1981年被中国医学科学院药物研究所黄量先生课题组从海南粗榧 (Cephalotaxus hainanensis Li) 中分离报道,并命名为“去甲基桥氧三尖杉新碱 (Demethylneodrupacine)”,但当时C2-OH构型未予确定;2021年,中国药科大学孔令义、罗建光团队从三尖杉 (Cephalotaxus fortunei Hook f.) 中分离得到了 Fortuneicyclidin A 和 Fortuneicyclidin B。迄今为止,在分离得到的生物碱化合物中,除了少量高刺桐类生物碱、海南新碱,已有近100个三尖杉碱类型生物碱 (Cephalotaxine-type Alkaloids) 被分离和鉴定,如图一所示,主要分子骨架涉及5种类型 (Type I-V),其中具有代表性的三尖杉碱 (Cephalotaxine) 的核心骨架为稠合A/B/C/D四环体系,其中D环拥有最密集的手性中心(C3/C4/C5(包括1个氮杂螺环季碳中心))和官能团组合(C1=C2/C3-O/C5-N)。重要的是,三尖杉碱是重要的抗白血病药物前体,与之相关的很多天然酯碱衍生物具有显著的抗肿瘤活性,我国在上个世纪70年代就已将三尖杉酯碱用于白血病相关的癌症疾病治疗研究,并于1990年载入中国药典。其后,2012年美国食品药品监督管理局批准了高三尖杉酯碱 (Homoharringtonine) 用于治疗慢性粒细胞白血病。
由于三尖杉类生物碱的独特结构与药用价值,天然三尖杉碱 (Cephalotaxine) 作为该家族系列生物碱的重要代表性分子,其化学合成已经引起了化学家、药物化学家的极大兴趣。1972年,Weireb和Semmelhack首次完成了Cephalotaxine的外消旋全合成,截止目前为止,已有外消旋(形式)合成报道32篇、不对称(形式)合成报道23篇,其中在此合成领域有重要贡献的国内学者包括钟三保 (1994)、李卫东 (2003/2005/2007/2011)、涂永强 (2009/2012)、杨华 (2009)、姜标 (2013/2017)、黄培强 (2013)、张志伟 (2013/2018)、洪然 (2015)、樊春安 (2017)、张建 (2022)等。
近日,兰州大学功能有机分子化学国家重点实验室樊春安课题组针对上述三尖杉类生物碱的对映选择性全合成,设计发展了一类新颖的“三级烯酰胺与烯醇重氮乙酸酯的不对称催化 (2+3) 成环反应”,一步高效构建了手性多官能团化的D环结构单元,同时结合Meinwald重排的策略性运用,实现了三种骨架类型三尖杉类生物碱 (−)-Cephalotaxine、(−)-Cephalotine B和 (−)-Fortuneicyclidin A与 B 的不对称多样性合成。
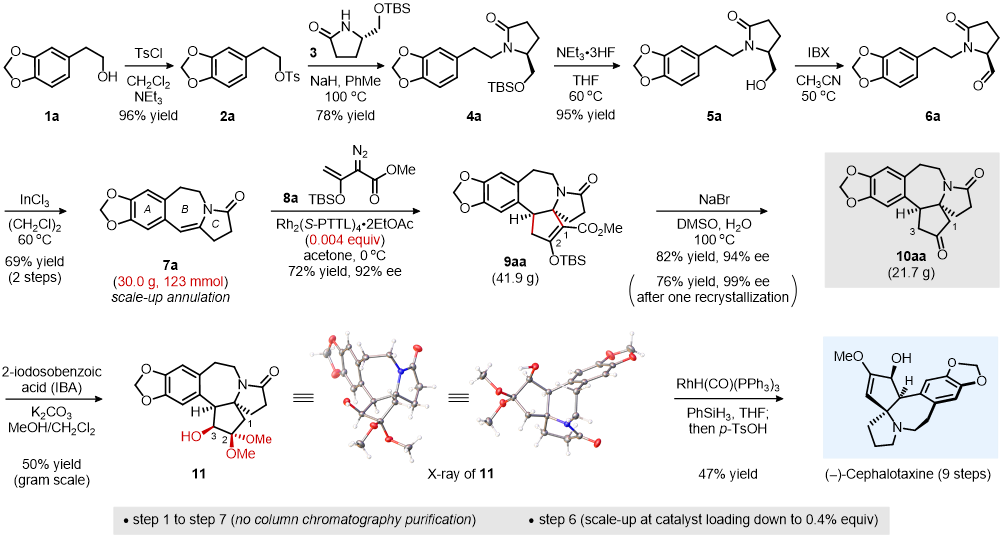
图二:(–)-Cephalotaxine对映选择性合成
如图二所示,从胡椒乙醇 1a 出发,经5步转化可得到三尖杉碱A/B/C三环骨架-烯酰胺7a。随后,以手性双核铑 (Rh2(S-PTTL)4·2EtOAc) 为催化剂,经过烯酰胺7a与烯醇重氮乙酸酯8a的关键不对称催化 (2+3) 成环反应,可以72%的产率、92%的ee值得到 (2+3) 成环产物9aa。值得一提的是,该关键反应可以30克规模进行,催化剂用量可低至0.4%,为潜在合成实用性的增加提供了可能。在NaBr/H2O/DMSO加热条件下,一步脱除9aa的烯醇硅基和C1位甲氧基羰基,得到含有A/B/C/D四环骨架的关键中间体10aa。然后在2-亚碘酰苯甲酸 (IBA) 的存在下,经过区域选择性α-羟基化/缩酮化,得到C3-β-OH产物11。在进一步RhH(CO)(PPh3)3催化的酰胺还原之后,在反应体系中原位加入p-TsOH脱除甲醇,实现了左旋三尖杉碱 (–)-Cephalotaxine的不对称全合成。该合成路线反应条件温和、可控,后处理简单,9步反应仅需2次柱层析,为后续 (–)-Cephalotaxine的规模化合成奠定了基础。
在完成 (–)-Cephalotaxine的全合成之后,该课题组又将注意力转向 (–)-Cephalotine B、(–)-Fortuneicyclidin A和 (–)-Fortuneicyclidin B的不对称合成研究。如图三所示,从上述合成的共同中间体10aa出发,基于反常的Riley SeO2氧化、可见光促进的苄位自由基溴代/水解 (1:4 dr)、Luche还原 (负氢从位阻较小的Si面进攻)、烯丙位C2-β-OH诱导的m-CPBA环氧化转化,得到可分离的15α和15β。接下来以主要异构体15β为起始,在p-TsOH的存在下,尝试了15β发生Meinwald重排的可能性,但遗憾的是只得到环氧开环的竞争性副产物氧桥化合物17。为了避免这一问题,首先对15β 中C2/C11羟基进行了乙酰化保护,而后在p-TsOH条件下发生Meinwald重排,然后一锅加入甲醇/K2CO3原位脱除乙酰基、半缩酮化,以66%的产率得到稳定的半缩酮化合物16。经过RhH(CO)(PPh3)3催化的酰胺还原,可实现 (–)-Cephalotine B的首次全合成。
从化合物15α和15β为出发,经二氧化锰氧化得到化合物18。在p-TsOH条件下,化合物18发生Meinwald重排,一锅加入DABCO促使其发生分子内aldol反应,以68%的产率得到19。在Vaska催化剂和TMDS条件下,将19中的酰胺还原为胺的半缩醛,而后一锅加入NaBH(OAc)3和AcOH,在质子性溶剂中原位还原生成胺,实现了 (–)-Fortuneicyclidin B的首次全合成。为了进一步翻转19中C2-OH构型,经过PCC氧化C2-β-OH、Zn(BH4)2化学选择性还原C2位羰基,得到了可分离的非对映异构体20和19 (1:1 dr)。然后,基于上述酰胺还原条件,通过C2-α-OH中间体20的酰胺还原,可实现 (–)-Fortuneicyclidin A的首次全合成。
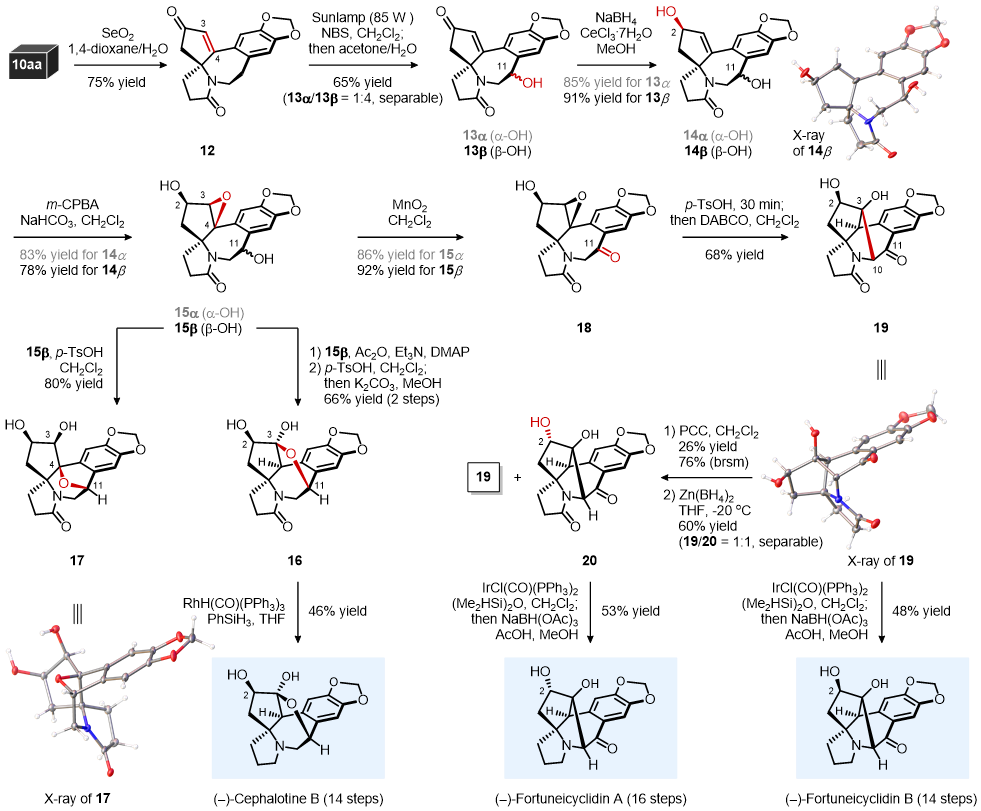
图三:(–)-Cephalotine B、(–)-Fortuneicyclidin B和 (–)-Fortuneicyclidin A的多样性全合成 (图片来源:J. Am. Chem. Soc.)
综上所述,樊春安课题组以铑催化的不对称 (2+3) 成环反应以及Meinwald重排等为关键转化,实现了三尖杉类生物碱 (−)-Cephalotaxine(9步/2次柱层析)、(−)-Cephalotine B (14步/首次合成)、(−)-Fortuneicyclidin B(14步/首次合成)和 (−)-Fortuneicyclidin A(16步/首次合成)的多样性全合成。此工作不仅在化学上为三尖杉类生物碱骨架中官能团化氮杂螺环结构的构建提供了新的 (2+3) 成环反应设计,而且在策略上展示了烯酰胺化学在相关结构天然产物合成中的应用前景。
谨以此文纪念兰州大学黄文魁先生 (1928-1982) 在上个世纪70年代开展三尖杉酯类生物碱合成的开创性研究。
相关成果近期发表在Journal of the American Chemical Society上,文章共同第一作者是博士后安显涛和博士研究生葛晓敏。
文章链接:https://pubs.acs.org/doi/full/10.1021/jacs.3c01572
Copyrights © All Rights Reserved 版权所有 兰州大学功能有机分子化学国家重点实验室 陇ICP备10000336号