近日,兰州大学功能有机分子化学国家重点实验室阳铭教授课题组完成了八角属倍半萜 illisimonin A 和 merrilactone A 的仿生多样性合成。相关结果近期发表在Angew. Chem. Int. Ed.(doi:10.1002/anie.202306367)上。
八角属倍半萜是从八角属(Illicium)植物中分离得到的一大类结构复杂多变的天然产物。部分该类天然产物具有很强的神经营养因子的活性,能够促进神经细胞在体外的生长,因此对该类天然产物及其类似物的活性研究有助于开发治疗神经退行性疾病的药物。从结构上来看,该类分子可根据其碳骨架的差异分为allo-cedrane,illisimonane,anislactone和seco-prezizaane四大类,而数量最多的seco-prezizaane类又可以根据内酯结构的不同分为anisatin,pseudoanisatin,pseudomajucin,cycloparvifloralone,majucin和 minwanensin六个亚类。
该类分子优异的生物活性及其复杂的多环结构吸引了国内外众多合成化学家的研究兴趣,目前已经有多个课题组完成了该家族分子的全合成工作,其中在此合成领域有重要贡献的国内学者包括翟宏斌、张延东和王博。相较于该类分子众多的活性和合成研究,到目前为止却缺乏针对该类分子相对详尽的生源合成假说,也无该家族分子的仿生合成研究报道。该课题组通过分析该家族天然产物的结构特点,首次较为详尽地提出了其生源合成假说(图一a)。与前人提出的碳正离子重排反应导致八角属倍半萜碳骨架多样性的假说不同,该课题组认为该家族分子碳骨架的多样性主要是由allo-cerdrane衍生的二羰基关键中间体通过相应的氧化,逆Dieckmann缩合,碳碳键氧化断裂(oxidative cleavage)以及aldol反应来实现。而不同碳骨架的氧化和内酯化又进一步构成了相应的亚类,从而丰富了八角属倍半萜的结构种类。
为了验证提出的碳骨架转化所涉及到的关键反应,该课题组设计了一条illisimonin A和merrilactone A的仿生多样性合成路线(图一b),期望利用钯催化的碳酸炔丙酯的脱羧烯基化反应和分子内的去对称还原Heck反应从化合物28合成allo-cerdrane衍生的二羰基关键中间体26,并且从此关键中间体出发,利用其提出的生源合成假说中关键的逆Dieckmann缩合,氧化切断(oxidative cleavage)碳碳键以及aldol反应实现碳骨架结构完全不同的 illisimonin A 和merrilactone A 的多样性合成。而化合物28可以从已知的环戊二酮衍生物29制备得到。

图一 八角属倍半萜的生源合成假说以及Illisimonin A和Merrilactone A逆合成分析
根据这一思路,作者首先合成了关键共同中间体26。从烯丙基环戊二酮29出发,通过Tsuji-Trost烯丙基化反应引入另外一条烯丙基侧链,得到二酮化合物31。接下来,作者希望对化合物31中的二酮进行双保护,但是由于位阻原因,仅有一个羰基能够被顺利保护。于是,作者首先利用烯烃复分解反应将两条烯丙基侧链关环以减小位阻,随后一锅法进行双乙二醇保护得到化合物32。之后,通过双羟化/氧化切断、Pinnick氧化、甲酯化三步反应得到酮酯化合物33。化合物33在叔丁醇钾的作用下发生Dieckmann缩合,得到的烯醇负离子中间体被氯甲酸炔丙酯34捕获,随后在 2 M 盐酸作用下化学选择性脱除一个乙二醇保护基得到化合物28。利用Franckevičius课题组发展的方法,碳酸酯28可以在钯催化的条件下顺利发生脱羧烯基化得到化合物35。三羰基化合物35中C4位羰基由于位阻相对较小,可以优先去质子化并转化为烯醇三氟甲磺酸酯27。最后烯醇三氟甲磺酸酯27可以在钯催化剂和大位阻膦配体的条件下发生分子内的还原Heck反应得到具有allo-cedrane碳骨架的关键共同中间体26。
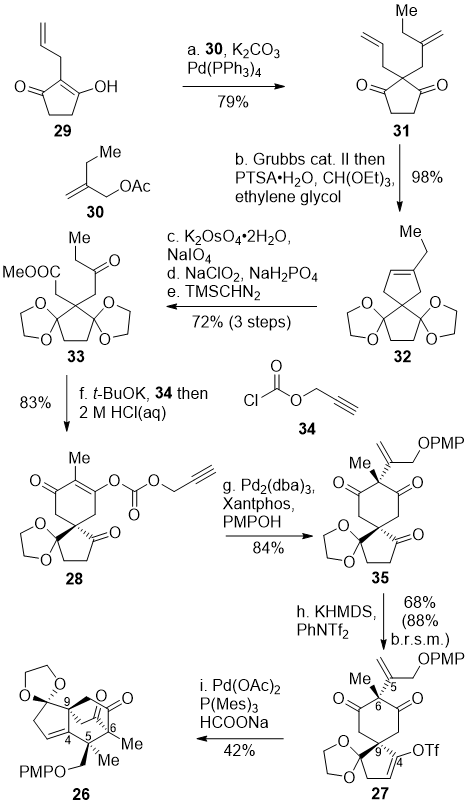
图二 关键共同中间体26的合成
在得到关键共同中间体后,作者首先尝试了从allo-cedrane骨架到illisimonane骨架的转化。Mukaiyama水合反应引入C4位的氧化态得到化合物36。化合物36在DBU做碱的条件下发生逆Dieckmann缩合反应,随后在过量盐酸溶液条件下一锅脱除乙二醇保护基得到内酯37。硝酸铈铵(CAN)氧化脱除化合物37的PMP保护基,得到的一级羟基与C11位羰基发生半缩酮化得到化合物38。为了区分C1位羰基和C11位的羰基,化合物38 C11位的半缩酮被转化成缩酮,同时,C1位羰基也会部分转化为二甲氧基缩酮和烯醇甲基醚。由于C11位的缩酮结构更稳定,C1位过保护的副产物可以在酸性条件下以丙酮作溶剂一锅法水解。在得到化合物39之后,作者通过两步反应引入C1位的甲基得到化合物40。Vedejs氧化在C8位引入羟基,随后Jones氧化并脱除缩酮保护得到α酮酯42。化合物42在TBD的催化下,发生半缩酮/酮互变异构,并发生aldol反应得到具有高张力反式5/5并环结构的illisimonane类型的碳骨架。最后,通过氢键诱导的Mukaiyama水合条件反应,高立体选择性地引入C1位的羟基,得到天然产物illisimonin A。
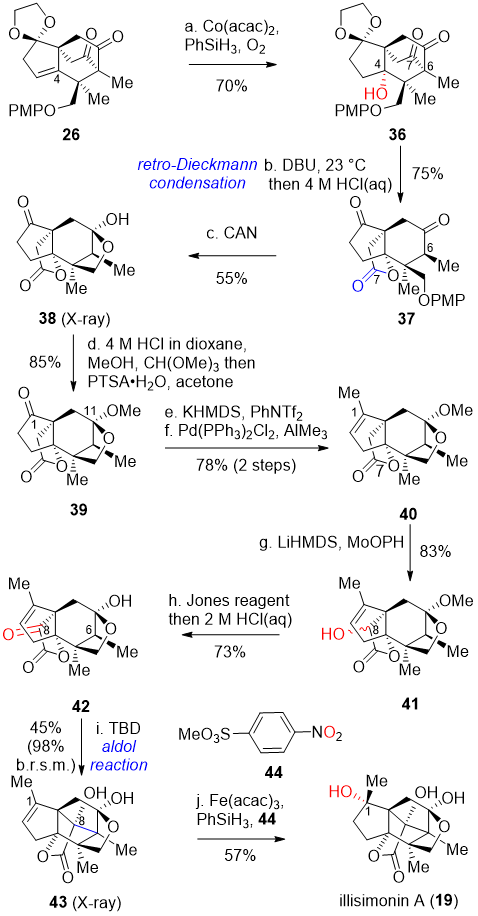
图三 Illisimonin A的消旋合成
在得到天然产物illisimonin A后,作者又对merrilactone A进行了合成研究。从化合物36出发,逆Dieckmann缩合反应得到化合物45。值得注意的是在乙二醇保护基存在的情况下,热力学稳定的逆Dieckmann缩合产物45的C6位甲基为α构型。Rubottom氧化引入C10位的氧化态,随后脱掉TES和PMP保护基得到化合物48。由于C6甲基构型的限制,该化合物并未发生分子内半缩酮化。在Pb(OAc)4做氧化剂的条件下氧化切断化合物48中的α羟基酮得到醛酯化合物49。接下来,化合物49在TBD的催化下发生aldol反应,得到具有annislactone类型碳骨架的化合物50。盐酸条件下脱除化合物50的乙二醇保护的同时,发生分子内酯交换反应,得到化合物51。对C1位羰基进行甲基铈试剂加成,随后在酸性条件下消除新生成的三级羟基的同时,再次发生分子内酯交换反应,得到翟宏斌课题组合成merrilactone A时的高级中间体 52。之后,可以通过四步转化得到merrilactone A。
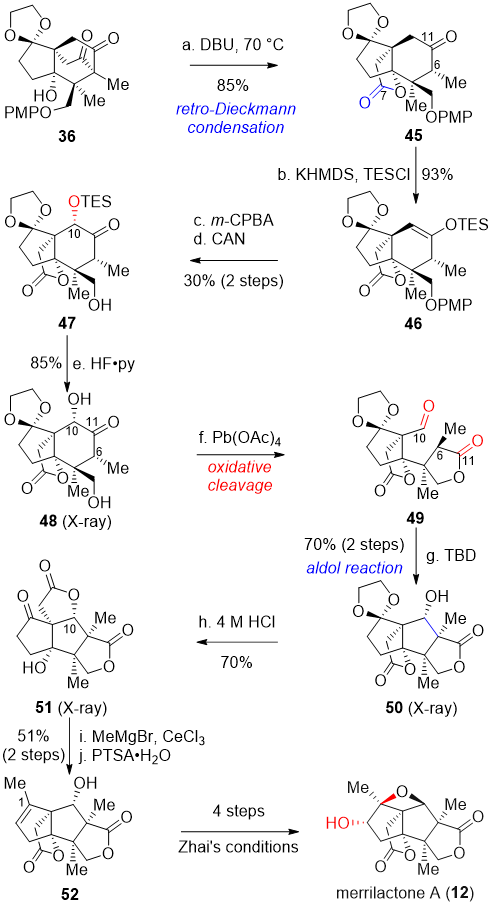
图四 Merrilactone A的消旋合成
为了实现该家族天然产物的不对称合成,该课题组希望对中间体27的对映选择性去对称化还原Heck反应进行研究。经过大量尝试,作者发现仅有汤文军课题组发展的膦手性中心单膦配体AntPhos (L1、L2)具有一定的对映选择性。随后,作者对该类配体进行了改造,并发现在C7位引入大位阻官能团和在C2位引入位阻官能团或者氢键给体能给出相对较好的对映选择性。最终,配体L7可以以82% 的ee值得到(+)-26,遗憾的是该反应收率较低,难以满足后续的全合成需求。
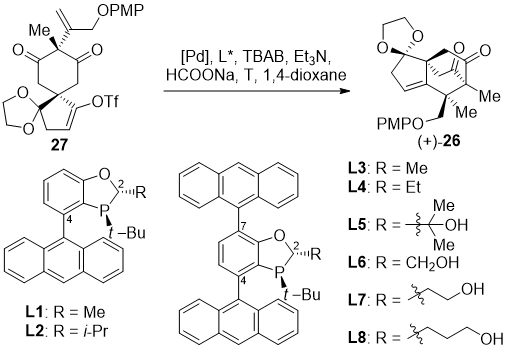
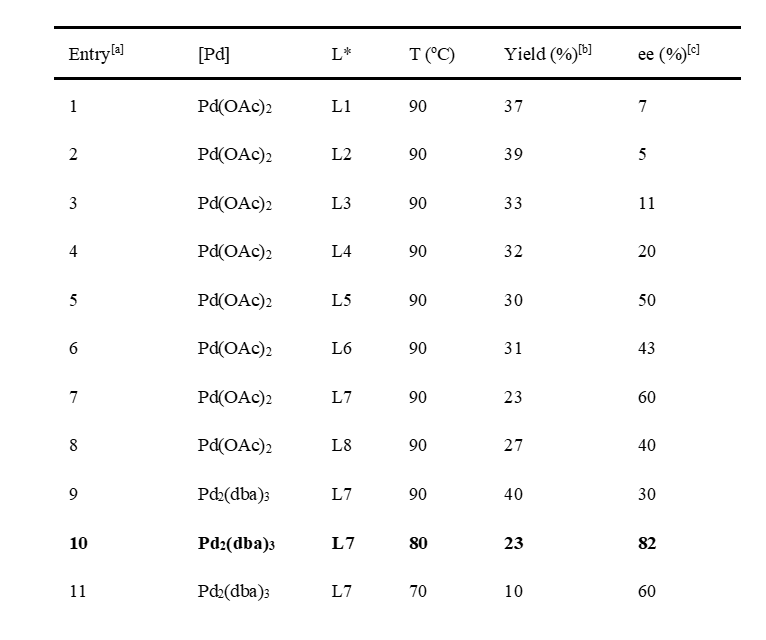
综上所述,阳铭教授课题组提出了八角属倍半萜较为全面的生源合成假说,并且通过对illisimonin A和merrilactone A的仿生多样性合成验证了生源合成假说中碳骨架重构的关键反应。同时,该课题组还对合成关键共同中间体的对映选择性去对称化的还原Heck反应进行了研究,并且设计一类新型膦手性中心单膦配体,取得了最高82%的ee值。
阳铭教授课题组研究助理宫旭为论文的第一作者,我校博士研究生黄娟和硕士研究生孙祥瑞为共同第一作者,硕士研究生陈子龄参与了该研究工作并起到了重要作用。
该工作受到国家自然科学基金青年基金和面上项目,甘肃省科技重大专项,兰州大学和功能有机分子化学国家重点实验室的大力资助。
文章链接:https://onlinelibrary.wiley.com/doi/epdf/10.1002/anie.202306367
Copyrights © All Rights Reserved 版权所有 兰州大学功能有机分子化学国家重点实验室 陇ICP备10000336号